来源:中国科学院遗传与发育生物学研究所 徐白
导语:瑞士巴塞尔大学分子生命科学中心的教授 Fiona Doetsch 2016年在 Cell Stem Cell 杂志上发表了一篇文章介绍了他们最近的一项研究成果。他们的研究表明在成年哺乳动物的大脑中,通常被忽略的脉络丛也可以作为神经干细胞的一个重要微环境,分泌一些因子至脑脊液,促进神经干细胞的增殖。那除了脉络丛,成年大脑中的神经干细胞是否还处于别的微环境中?以下我们将围绕大脑中脑室下区神经干细胞所处的由三个部分组成的微环境来介绍它们是如何影响神经干细胞的细胞命运,以及在未来科学家们还可以做哪些研究。
神经干细胞存在于神经系统中特定的微环境里,这样的微环境能维持神经干细胞的自我更新和多向分化的能力。在成年哺乳动物大脑中,仍然有两个区域会存有神经干细胞,并且这些神经干细胞能持续地产生新生神经元,并整合进局部的神经回路中。一个区域是位于侧脑室附近的脑室-脑室下区,这里的神经干细胞能生成嗅球中的神经元。另一个区域位于海马的颗粒下层,在这儿神经干细胞可以生成齿状回的颗粒神经元 (图 1)。大部分神经干细胞在脑内处于静止状态,但偶尔也会被激活,接着发生分裂。
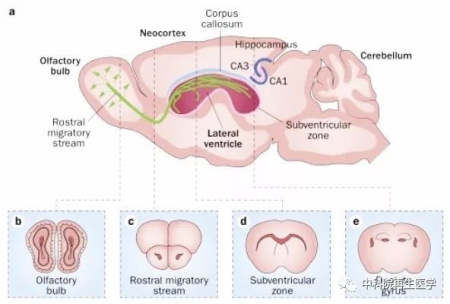
Zhao et al Cell 2008, 132(4): 645
图 1 成年大脑内产生神经干细胞的区域。(a) 一个矢状面的成年小鼠大脑切片,位于侧脑室下方的脑室下区 (subventricular zone) 和位于海马齿状回的颗粒下层 (subgranular zone) 存在神经干细胞。其中,脑室下区的新生神经元 (绿色) 可以迁移至嗅球。
我们知道,静止期的神经干细胞在受到一些胞内和胞外的信号调节作用下会被激活,进行自我更新或者是分化。并且胞内和胞外的信号调控会始终维持一种精确的平衡,使神经干细胞池不至于耗竭。值得注意的是,来自胞外的信号分子可能会随着时间变化,从而对神经干细胞施加一些阶段特异性的作用。因此,本文将主要围绕脑室下区着重讨论神经干细胞的微环境中信号分子是如何调节成年神经干细胞的细胞命运,以及微环境是如何随着年龄改变的。
脑室下区神经干细胞微环境解剖
脑室下区主要由三层组成,紧贴着侧脑室的壁。三层结构分别是:靠近侧脑室壁的室管膜细胞层,中间的成神经细胞层,和血管周围细胞层 (图 2)。其中,室管膜细胞层紧贴着侧脑室的侧壁,成神经细胞层则贯穿整个脑室下区。在血管周围细胞层,一些细长而平直的血管丛从脑室下区延伸出来,血管周围还有一些胞外基质。
在脑室下区,神经干细胞的胞体位于富含成神经细胞的中间层,但是它们能伸出短小的触角与室管膜细胞层形成连接,同时接触到脑脊液,此外它们还能伸出较长的触角连接到血管周围细胞层。因而,脑室下区的神经干细胞暴露在一个由三个部分组成的微环境中:脑脊液/室管膜细胞层,成神经细胞层和血管周围细胞层。神经干细胞同时接受这三部分发放的刺激信号。
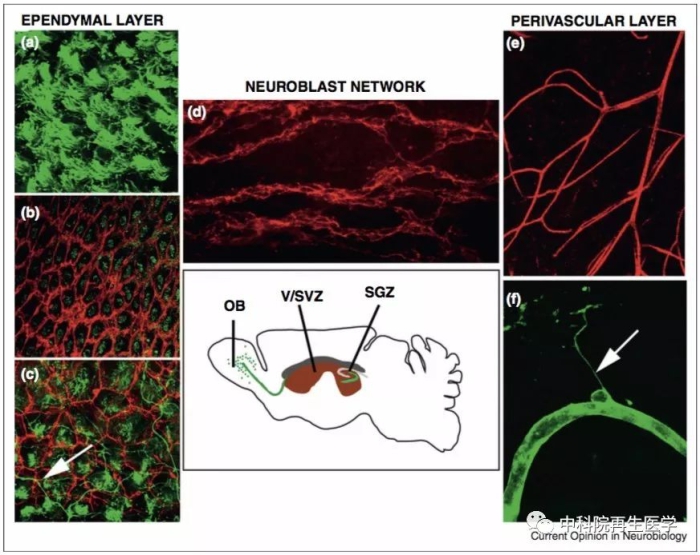
Doetsch et al Current Opinion in Neurobiology, 2013 , 23 (6): 935
图 2 脑室下区微环境的结构解析。成年小鼠大脑矢状面示意图展示出两个神经发生的区域:脑室下区和颗粒下层区。脑室下区紧贴着侧脑室(红色)的侧壁,并且可以生成神经元,迁移至嗅球部位。颗粒下层区可以产生齿状回的颗粒神经元。组织切片显示出脑室下区的三层结构:脑脊液/室管膜细胞层,成神经细胞层和血管外细胞层。(a-c) 室管膜细胞层靠着侧脑室的侧壁,并且呈现出类似风车样的排列。(d) 成神经细胞层连成网,贯穿 SVZ 区。(e) 细长而平直的血管从SVZ 区延伸出去 (红色)。(f) 基底膜的成分胞外基质从血管外细胞层延伸出去,终止于室管膜细胞层。
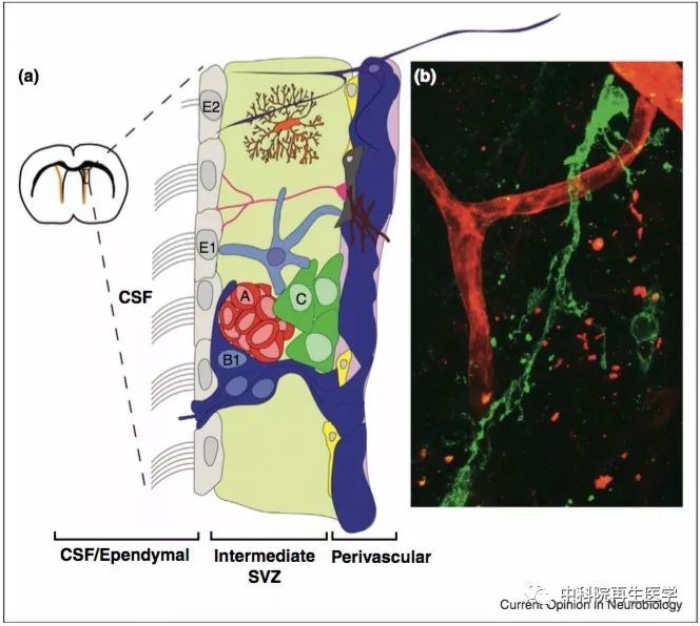
Doetsch et al Current Opinion in Neurobiology, 2013, 23 (6): 935
图 3 脑室下区微环境中的细胞类型。(a) 脑室下区在大脑中位置的冠状面示意图。脑脊液/室管膜细胞层的细胞类型有:室管膜细胞 (灰色),神经干细胞 (深蓝色)。中间的成神经细胞层的细胞类型有:神经干细胞 (深蓝色),过渡放大细胞 (绿色),成神经细胞 (红色),小胶质细胞 (橘色),长距离的轴突终端 (紫色)。血管外细胞层的细胞类型有:内皮细胞 (粉红色),周细胞 (黄色),星形胶质细胞终足 (深蓝色),巨噬细胞和成纤维细胞 (深灰色),胞外基质 (品红色)。(b)神经干细胞 (绿色) 具有一个星形胶质细胞的外形,并且伸出一个长长的触角接触血管 (红色)。
脑脊液/室管膜细胞层——富含信号分子调节神经干细胞增殖分化
在脑脊液/室管膜细胞层中的神经干细胞可以直接接触脑脊液,而脑脊液里含有很多信号分子,所以这个微环境与神经干细胞的信号通路,细胞之间的相互作用有重要关系 (图 3)。脑脊液除了可以维持大脑内环境的稳态,它对神经干细胞的增殖和分化也有影响。在胚胎期哺乳动物大脑中,脑脊液能促进神经前体细胞的增殖,其中 IGF-2 是一个关键因子。在成年哺乳动物的脑脊液中,TGFs,IGFs,PDGFs,SHH,Wnts,BMPs,Slits 和维甲酸等都对神经干细胞的增殖和分化有影响。脑脊液中的各种因子除了对与其接触的神经干细胞有直接作用,随着脑脊液在大脑内的流动,甚至对迁移至嗅球的成神经细胞也有影响。所以,脑脊液能同时影响神经干细胞、过渡放大细胞及成神经细胞。
此外,脑室下区绝大多数的神经干细胞维持在静止的状态。神经干细胞之所以能维持静止状态,可能与其伸出触角“锚定”在室管膜细胞层和血管外细胞层有极大关联。比如在脑脊液/室管膜细胞层,大多数与侧脑室侧壁接触的神经干细胞都处于静止状态。其中,一些受体和因子可能对维持神经干细胞的“锚定”起了一定作用。比如位于神经干细胞表面存在的 VCAM1 受体,如果破坏该受体的信号通路会导致神经干细胞从室管膜细胞层脱落,从静止状态被激活,发生增殖。另外,Il1-b 是一个来源于脑脊液的因子,它可以通过调节 VCAM1 的表达,从而维持神经干细胞的静止状态。
成神经细胞层——神经递质和反馈共同调节神经干细胞增殖
位于室管膜细胞层和血管周围细胞层之间的成神经细胞层主要包括神经干细胞的胞体,过渡放大细胞,成神经细胞以及一些小胶质细胞 (图 3)。在该层中,神经递质对神经干细胞起主要的调节作用。此外,GABA 信号通路也参与调控神经干细胞的静止和激活。
在该层中,长距离的神经支配会控制神经干细胞的增殖。脑室下区会受到来自于远端大脑的轴突的支配,包括一些 5-羟色胺能阳性的神经元轴突,或者一些黑质的多巴胺能神经元轴突。纹状体的 NADPH 神经元也会发出轴突支配颗粒下层。轴突终端会释放一些神经递质,从而影响神经干细胞的增殖。
来自于过渡放大细胞和成神经细胞的反馈会通过细胞间的互作以及信号分子直接调节神经干细胞的增殖。如果使用一些化疗药物将处于分裂期的神经干细胞耗竭,处于静止期的神经干细胞会被激活。此外,成神经细胞会分泌一些GABA,和神经干细胞表面的受体结合,抑制神经干细胞增殖。神经干细胞和过渡放大细胞也会表达一些 DBI,调节 GABA 活性,促进神经干细胞增殖。
神经干细胞和小胶质细胞等其他细胞发生互作在该层中也很常见。小胶质细胞是损伤或者感染后炎症反应中关键的因子。在正常生理状况下,小胶质细胞可能会吞噬新生的神经元。反之,神经前体细胞也会分泌一些因子调节小胶质细胞的活性和功能。
血管周围细胞层——基底膜和血流中的因子发挥重要作用
在大脑中,血管由连接紧密的内皮细胞构成。内皮细胞外面包绕着周细胞。基底膜同时覆盖在内皮细胞和周细胞表面。星形胶质细胞的终足同时把内皮细胞、周细胞和基底膜包裹在一起,形成大脑中的血脑屏障。血脑屏障可以有效阻止血液中的有害物质进入大脑。但是脑室下区的脉管系统和大脑其他部分不同,此区的血管比较独特。在大脑内非神经发生区的血管往往是扭曲的形状,但是脑室下区的血管是细长而平直的。一些基底膜的成分,即胞外基质会沿着血管延伸出去,终止于室管膜细胞层之下的一些大的球状结构上。神经干细胞和过渡放大细胞通过没有终足和周细胞覆盖的区域直接接触血管的胞外基质。前文也提及,神经干细胞的“锚定”对它们的命运具有重要作用。破坏神经干细胞与胞外基质的“锚定”,会引起神经干细胞脱离该层微环境,并且发生增殖状态的改变。不同的胞外基质会结合不同的生长因子和信号分子,影响神经干细胞的命运。
血流中的一些信号分子对神经干细胞的归巢、自我更新、增殖和分化很重要。β纤维素、PEDF 和 SDF-1 是来源于血管中的会影响神经干细胞的信号分子。其中,阻止神经干细胞与胞外基质接触的信号分子可以促进增殖,有利于神经干细胞与胞外基质接触的信号分子可能反而会维持神经干细胞的静止状态。
从年轻到年老——脑室下区微环境的改变
机体在衰老的过程中,脑室下区神经干细胞的数量、增殖和神经发生会极大地减少。这是由于神经干细胞内在状态的改变,以及来源于外在微环境中信号分子的改变而导致。但是 Fiona Doetsch 的研究表明,随着年龄的增长,外在微环境的改变相比于内在因素对神经干细胞的命运具有更加重要的调控作用。
微环境中很多组分都会受到衰老的影响。室管膜细胞排列成的“风车结构会逐步受到破坏,室管膜细胞也会逐渐丢失,并逐步被星形胶质细胞替代。此外,剩余的室管膜细胞中脂滴的含量会增加,其代谢和分泌的蛋白质也会发生改变。脉络丛上皮分泌脑脊液的能力也在减弱,并且脑脊液的成分也会变化。然而,对于血管外细胞层的改变,目前却知之甚少。但总体而言,神经干细胞的增殖能力会降低。
未来的研究方向
首先,虽然关于脑室下区神经干细胞微环境成分的研究已经有很多进展,但是仍然不够细致和全面。一个理想的方法是尝试把微环境中不同种群的细胞纯化出来,确定这些细胞各自分泌了哪些因子,以及这些因子在体内的分布情况,在此基础上去研究它们对神经干细胞的作用。其次,微环境中的代谢状态也会对神经干细胞的增殖和分化产生长远的影响,所以确定微环境中存在的代谢产物,以及对神经干细胞有何影响也尤为重要。最后,开发一些更先进的体内成像技术对于直接观察不同刺激下神经干细胞的动态变化极为有用。
本文参考文献:
1. Silva-Vargas V, Crouch E E, Doetsch F.Adult neural stem cells and their niche: a dynamic duo during homeostasis,regeneration, and aging. [J]. Current Opinion in Neurobiology, 2013, 23(6):935.
2. Tavazoie M, Van d V L, Silvavargas V, etal. A specialized vascular niche for adult neural stem cells. [J]. Cell StemCell, 2008, 3(3):279-288.
Doetsch F. A niche for adult neural stemcells. [J]. Current Opinion in Genetics & Development, 2003, 13(5):543-550.
3. Silvavargas V, Maldonadosoto A R, Mizrak D, etal. Age-Dependent Niche Signals from the Choroid Plexus Regulate Adult NeuralStem Cells. [J]. Cell Stem Cell, 2016, 19(5):643.
编辑:李佳音