腺苷(Adenosine,Ado)是生命活动的核心调控分子,在神经可塑性、运动功能、学习记忆及睡眠调节中扮演多重角色。其作用机制因细胞内外定位差异而截然不同:胞外腺苷(eAdo)如同“信号调度员”,通过A1、A2A、A2B及A3等GPCR受体调控神经传递、免疫应答及心血管舒张,其动态平衡则影响炎症反应与肿瘤微环境等演变;而胞内腺苷(iAdo)则是能量代谢的“隐形操盘手”,作为ATP代谢的核心产物,通过动态平衡参与核酸合成、能量稳态及信号转导,其浓度波动间接反映细胞能量状态。eAdo和iAdo两者通过ENT转运蛋白形成跨膜对话网络,其失衡神经退行性疾病及代谢综合征、肿瘤等重大疾病密切相关。然而,受限于传统技术难以捕捉iAdo毫秒级动态变化及亚细胞定位规律,关于腺苷的细胞来源、释放机制以及跨膜转运的具体过程仍存在诸多争议。
2025年5月7日,中国科学院遗传与发育生物学研究所武照伐课题组,联合北京大学药学院王晶课题组和北京大学生命科学学院李毓龙课题组,在Nature Communications杂志发表题为A high-performance fluorescent sensor spatiotemporally reveals cell-type specific regulation of intracellular adenosine in vivo的文章,该研究成功开发了首个用于检测胞内腺苷的基因编码荧光探针HypnoS(Hypersensitive intracellular adenosine Sensor),并借助活体成像与光遗传技术等手段,探究了活体动物中胞内腺苷时空动态上的细胞特异性调控,以及背后的分子调控机制。
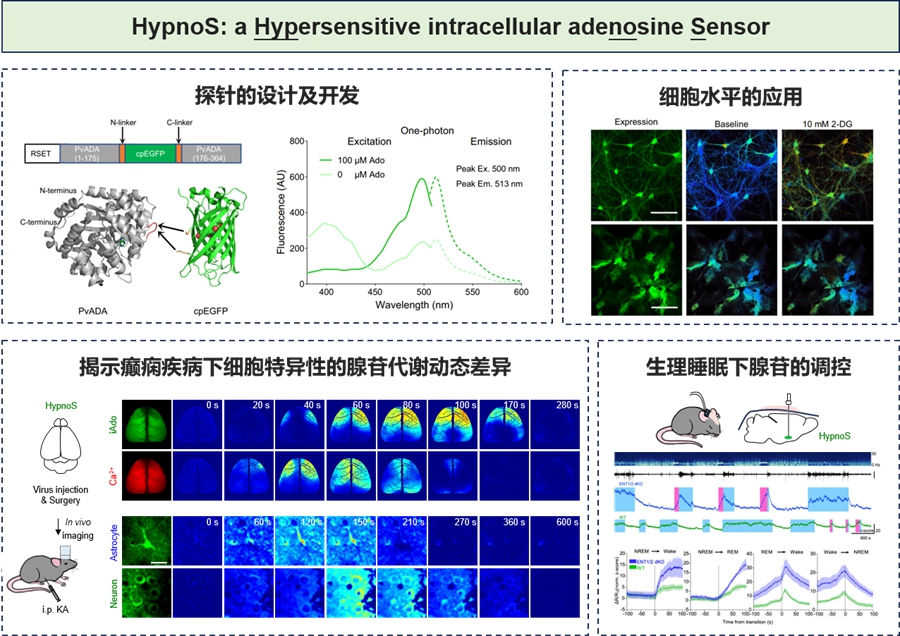
研究团队基于循环重排绿色荧光蛋白(cpEGFP)与腺苷脱氨酶(PvADA),在筛选了超过3000个突变体后,成功构建了新型荧光探针HypnoS(取名古希腊神话中的“睡神”),该探针的最大响应幅度~900%,具有亚秒级响应速度和优异的底物选择性,且对细胞正常生理活动无明显干扰。利用HypnoS实现了细胞、组织和活体动物(果蝇、小鼠)水平胞内腺苷的时空动态可视化。
在病理过程中(如癫痫),腺苷被认为是重要的内源性抗惊厥因子。结合HypnoS探针和在体大视场成像技术,研究团队在活体小鼠大脑中以整个皮层为空间尺度,高时间分辨率地可视化了癫痫发作期间胞内腺苷的动态变化,揭示了胞内腺苷在癫痫中的潜在神经保护作用。进一步,研究团队将HypnoS分别在神经元及星形胶质细胞中特异性表达,并运用在体双光子成像技术,以单细胞分辨率解析了胞内腺苷在不同细胞类型中的动态变化。
在生理过程中(如睡眠-觉醒),腺苷被认为是调控睡眠稳态的重要分子。研究团队利用HypnoS探针结合光纤和脑电、肌电记录,在小鼠基底前脑研究中捕捉到清醒与REM睡眠时期胞内腺苷升高,NREM睡眠时期下降的现象。研究表明,ENT1/2在神经元中主导腺苷释放,而在星形胶质细胞中促进腺苷摄取,揭示了两种细胞在睡眠稳态中的分工机制。这一发现为通过调控腺苷水平干预睡眠障碍提供了分子基础。
北京大学药学院王晶教授、中国科学院遗传与发育生物学研究所武照伐研究员和北京大学生命科学学院李毓龙教授为论文共同通讯作者。王晶课题组博士生魏庆鹏、武照伐课题组博士生白泽枭和李毓龙课题组博士生王蕾为共同第一作者。该研究获得中国科学院、基金委、科技部和北京市科协“青年人才托举工程”等机构、经费和项目的大力支持。