杨崇林实验室揭示细胞内物质运输调控的新机制
发布时间:2016.01.19
细胞生物学领域著名学术期刊Journal of Cell Biology近期以Article形式发表了杨崇林实验室的最新研究论文 (http://jcb.rupress.org/content/212/2/181.full)。该论文揭示了细胞内吞体上磷酯酰肌醇 3-磷酸(PtdIns3P)的调控机制。
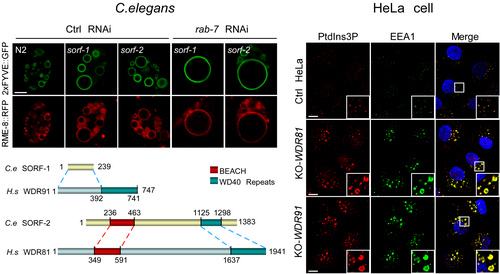
内吞体是细胞摄取的外部物质或内质网合成的蛋白向溶酶体递送的中间载体。由内吞体介导的向溶酶体的运输通路对于发育信号调控至关重要。该通路中的内吞体主要有两种:早期内吞体和晚期内吞体。早、晚期内吞体上分别具有特征性的Rab GTP酶和磷酯酰肌醇磷酸。早期内吞体上有较高水平的PtdIns3P,它调节早期内吞体融合、内吞体上的受体或其它组分的循环回收。与之相反,晚期内吞体上PtdIns3P的水平非常低,其特征性磷酯酰肌醇磷酸为PtdIns(3,5)P2。但造成早、晚期内吞体上PtdIns3P的水平差异的调控机制却不甚明了。
中科院遗传发育所分子发育生物学国家重点实验室杨崇林课题组运用突变体筛选和基因克隆方法,在模式动物秀丽线虫中发现了两个新的基因,sorf-1和sorf-2。它们的突变体表现为早期内吞体异常增大,且出现内吞体运输障碍。研究发现sorf-1和sorf-2突变体中内吞体上PtdIns3P水平显著增加,导致内吞体的过度融合而使体积变大。当阻断早、晚期内吞体上的小GTP酶Rab5向Rab7转换时,sorf-1和sorf-2突变导致早期内吞体上PtdIns3P不能降低,从而驱动它们之间持续融合,形成异常巨大的内吞体,阻断向溶酶体方向的运输通路。研究表明SORF-1和SORF-2形成蛋白质复合体,并与PI3K复合体的Beclin1亚基相互作用,抑制PI3K复合体的激酶活性,使内吞体在转换过程中PtdIns3P的合成受到抑制,从而使内吞体转换得以进行,并使晚期内吞体上PtdIns3P处于极低的水平。
该研究还发现,人类细胞中SORF-1和SORF-2的同源蛋白WDR91和WDR81也形成复合体,并与Beclin1互作而抑制内吞体上PtdIns3P的生成。WDR81的突变与人类发育疾病CAMRQ2紧密相关。该疾病表现为小脑发育缺陷、智障,四肢行走,但病理机制未知。因此,本项研究表明细胞内吞体运输障碍很可能是该综合征的主要发病机制。此外,研究者预期WDR91也可能与某种待发现的遗传疾病密切相关。
同期J Cell Biol将该论文列为焦点报道(In Focus: Making sure late endosomes are on time) (http://jcb.rupress.org/content/212/2/127.full)。杨崇林实验室博士生刘锴、副研究员蹇友理和已毕业博士生孙晓娟为该论文的共同第一作者。该研究受到国家自然科学基金委、科技部以及中科院项目资助。